中國的藥品安全監管狀況
中華人民共和國國務院新聞辦公室
二〇〇八年七月·北京
目 錄
一、藥品供應和質量安全概況
二、藥品安全監管的體制與法制
三、藥品安全監管的政策措施
四、中藥和民族藥的監管
五、藥品安全監管的國際交流與合作
藥品是人類用於預防、治療、診斷疾病的特殊商品,對藥品實施有效監管,關係到廣大消費者的用藥安全,關係到公眾生命健康權益的維護和保障。中國政府一貫高度重視藥品安全監管,多年來以強化藥品安全監管、保障公眾用藥安全為目標,逐步建立健全藥品安全監管體制與法制,不斷完善藥品供應體系,穩步提高藥品質量安全保障水平,積極維護公眾用藥權益,努力提高公眾的健康水平。
一、藥品供應和質量安全概況
中國政府為醫藥産業發展積極創造開放公平的市場環境,大力推動醫藥産業實現持續快速健康發展。經過新中國成立近60年特別是改革開放30年來的不懈努力,中國不僅改變了缺醫少藥的局面,而且藥品質量安全保障水平得到了明顯提高。
目前,中國可生産原料藥1500種,且多個藥物品種産量位居世界第一,如青黴素、維生素C等。一批植物藥和天然藥物,如抗感染的黃連素、抗腫瘤的秋水仙鹼等,已經在國內大量生産和廣泛應用。抗生素、維生素、激素、解熱鎮痛藥、氨基酸、生物鹼等産品在國際醫藥市場上佔有相當的份額。中國生産的青蒿素産品,在國際上被廣泛使用,為防治瘧疾作出了重要貢獻。現今中國可以生産預防26種病毒、病菌感染的41種疫苗,年産量超過10億個劑量單位,其中,用於預防乙肝、脊髓灰質炎、麻疹、百日咳、白喉、破傷風等常見傳染病的疫苗産量達5億人份。國産疫苗在滿足國內居民防病需求的同時,已開始向世界衛生組織提供,用於其他國家的疾病預防。在醫療器械方面,中國可生産3000多個品種,其中,數字X光機、磁共振、超聲、CT等技術含量高的診斷治療類産品在市場上佔據了一定份額。截至2007年底,中國共有藥品生産企業(含中藥飲片和醫用氧生産企業)6913家,其中原料藥和製劑生産企業4682家;醫療器械生産企業12591家。
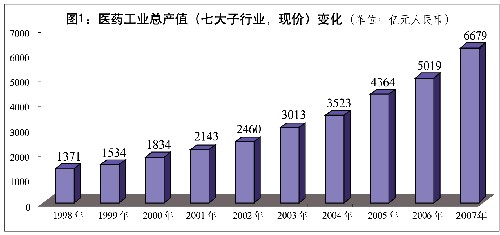
圖表:圖1:醫藥工業總産值(七大子行業,現價)變化 新華社發
近年來,中國醫藥工業總産值和醫藥貿易大幅度增加。按照中成藥、中藥飲片、化學原料藥、化學藥品製劑、生物製品、醫療器械、衛生材料等七大類統計,中國醫藥工業總産值由1998年的1371億元人民幣上升到2007年的6679億元人民幣。醫藥貿易出口額1998年為34億美元,2007年為246億美元;進口額1998年為15億美元,2007年為140億美元。
為防止仿製藥無償利用新藥開發研究數據,損害新藥開發的原動力,中國認真履行加入世界貿易組織的承諾,實施藥品數據保護制度。2002年,修訂《中華人民共和國藥品管理法實施條例》,規定對獲得生産或者銷售含有新型化學成分藥品許可的生産者或者銷售者提交的自行取得且未披露的試驗數據和其他數據,給予6年保護期限。
國家實施特別審評審批程序,鼓勵創制新藥和研發治療疑難危重疾病的新藥。適用特別程序的新藥包括:未在國內上市銷售的從植物、動物、礦物等物質中提取的有效成分及其製劑;新發現的藥材及其製劑;未在國內外獲准上市的化學原料藥及其製劑、生物製品;治療艾滋病、惡性腫瘤、罕見病等疾病且具有明顯臨床治療優勢的新藥;治療尚無有效治療手段的疾病的新藥。從1998年到2007年底,共有78個一類新藥獲得批准。制藥企業的技術水平與生産工藝有了大幅度改進,首創了一批新工藝、新技術、新方法,如維生素C二步發酵、黃連素合成、高純度尿激酶生産方法和裝置等。青黴素孢子高單位菌種選育和相應發酵、頭孢菌素C發酵等新工藝達到世界先進水平。中國不僅能夠生産供出口的中型醫療設備,在可穿載技術、生物醫學材料和組織工程等方面的研究,也正逐步進入世界前列。
國家加快了現代醫藥物流和連鎖藥店建設,有效保障公眾用藥的可獲得性。截至2007年底,全國共有藥品批發企業1.3萬家,藥品零售企業和門店經營企業34.1萬家,農村藥品供應網點55.4萬個,極大地方便了廣大公眾的用藥需求。隨著生活水平的不斷提高,中國人均藥品消費水平穩步增長,2006年達到人均332元人民幣。
中國建立了藥品不良反應報告和監測網絡。1998年,中國正式加入世界衛生組織國際藥品監測合作中心。2004年,國家發佈《藥品不良反應報告和監測管理辦法》,明確實行藥品不良反應報告和監測制度。到2002年底,全國31個省、自治區、直轄市都建立了省級藥品不良反應監測機構,建立了200多個省級以下的藥品不良反應監測中心或監測站,國家藥品不良反應監測信息網絡覆蓋全國,實現了電子報告和在線實時報告。自2000年以來,中國藥品不良反應報告工作取得明顯進展,2007年的藥品不良反應病例報告數量為每百萬人口400多份,接近發達國家的監測報告率,表明中國藥品不良反應監測和預警能力有了較大提高。藥品監管部門及時匯總、評價和發佈藥品不良反應報告信息,截至2008年6月底已發佈藥品不良反應信息通報13期,涉及44個品種。
藥品監管部門積極探索推進藥品再評價工作,對部分上市後品種開展安全性觀察試驗試點和回顧性分析調查。通過評價分析,修改了葛根素注射液、穿琥寧注射液、蓮必治注射液等品種的説明書,取消了關木通藥用標準,取消了乙雙嗎啉的生産許可,對一些品種採取了暫停銷售使用的措施。
國家積極推進建立醫療器械不良事件監測和再評價體系。2004年,在全國推行醫療器械不良事件監測工作。截至2006年底,全國31個省、自治區、直轄市建立了省級醫療器械不良事件監測機構,初步建立了醫療器械不良事件監測組織框架。依據不良事件監測和再評價結果,藥品監管部門分別對聚丙烯酰胺水凝膠、體外循環管道、透析粉等産品採取了撤銷産品註冊證、責令召回、重新註冊等措施。
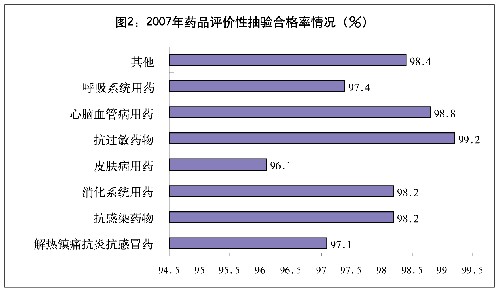
圖表:圖2:2007年藥品評價性抽驗合格率情況 新華社發
國家不斷加大對已上市藥品的質量監督抽驗力度,促進藥品質量安全水平穩步提高。2007年,國家對中成藥、化學藥品、生物製品等開展了評價性抽驗,共抽驗13595批次,總體合格率為98.0%。其中,化學藥品抽驗7398批次,合格率為98.0%;抗生素抽驗2586批次,合格率為98.1%;中成藥抽驗3611批次,合格率為97.6%。流感疫苗的抽驗合格率,連續兩年為100%。對抽驗不合格的藥品、醫療器械,藥品監管部門採取了責令召回、撤市以及行政控制等措施,依法進行處理。同時,國家採取一系列措施嚴厲打擊制售假冒偽劣藥品行為,確保公眾用藥安全。
二、藥品安全監管的體制與法制
多年來,中國政府不斷建立健全藥品安全監管體制,完善藥品安全監管技術支撐體系和藥品安全監管法律法規體系,為藥品安全監管提供體制和法制保障。
1998年中國組建了國家藥品監督管理局,並於2003年成立國家食品藥品監督管理局,負責對藥品(包括中藥材、中藥飲片、中成藥、化學原料藥及其製劑、抗生素、生化藥品、放射性藥品、血清、疫苗、血液製品和診斷藥品等)以及醫療器械的研究、生産、流通、使用進行行政監督和技術監督。目前,中國已建成了中央政府統一領導、省以下垂直管理的藥品監管行政機構。截至2007年底,全國有藥品監管行政機構2692個,其中,省級藥品監管行政機構31個,市(地)級藥品監管行政機構339個,縣(市)級(含直轄市區縣)藥品監管行政機構2321個。建立藥品監管技術監督機構1000余個。全國共有監管人員6.4萬人。在廣大農村地區,通過聘請藥品安全協管員、信息員,維護農村藥品安全,推進藥品安全監督網建設。截至2007年底,全國共聘請農村藥品安全協管員9.7萬餘人、信息員51.4萬餘人,建立農村藥品監督網點達57.8萬個。
國家不斷加大藥品安全監管的財政投入,重點提高藥品安全檢驗檢測能力和水平,為藥品安全監管工作提供技術支撐。國家級藥品技術監督機構主要包括:國家食品藥品監督管理局下屬的中國藥品生物製品檢定所、國家藥典委員會、藥品審評中心、藥品認證管理中心、國家中藥品種保護審評委員會、藥品評價中心、國家藥品不良反應監測中心、醫療器械技術審評中心等。這些機構重點承擔日常檢驗檢測、檢驗技術方法研究、實驗動物保種、標準化研究、註冊申請技術審評、藥品不良反應監測等工作。此外,還有19個國家口岸藥檢所承擔進口藥品的註冊檢驗和口岸檢驗,33個省級藥品檢驗所負責轄區內藥品抽驗、復驗、委託檢驗、藥品註冊復核檢驗、國家計劃抽驗以及國家藥品標準起草等工作,325個地市藥品檢驗機構負責轄區內藥品抽驗和委託檢驗。
在醫療器械監管方面,初步建立起由國家和省兩級機構組成的醫療器械技術檢測體系。其中,國家級醫療器械質量監督檢驗中心有10個,主要承擔境內第三類醫療器械、進口醫療器械産品註冊檢驗和國家醫療器械産品質量抽驗;省級醫療器械檢驗機構有30個,主要承擔轄區內醫療器械監督抽驗和部分醫療器械産品註冊檢驗;具有專業特長的高等院校、科研機構設立的醫療器械檢測機構有9個,作為醫療器械檢測能力的補充。還有22個不同專業的醫療器械專業標準化技術委員會,負責不同專業範圍的醫療器械標準化工作。
中國重視藥品安全監管的法律法規體系建設。1984年,全國人大常委會審議通過《中華人民共和國藥品管理法》,第一次以法律的形式對藥品研製、生産、經營和使用環節進行規定,明確了生産、銷售假劣藥品的法律責任,標誌著中國藥品監管工作進入了法制化軌道。該法于2001年進行修訂,修訂的主要內容包括:統一藥品標準,取消了地方標準;加重了生産、銷售假劣藥品的法律責任;將藥品生産、經營質量管理規範作為法定要求予以明確。《中華人民共和國藥品管理法》以及相關法律法規,為加強藥品監管,保證藥品質量,維護人民群眾用藥權益提供了法律保障。
截至目前,國務院共頒布了17部與藥品相關的行政法規,主要包括《關於加強食品等産品安全監督管理的特別規定》、《中華人民共和國藥品管理法實施條例》、《麻醉藥品和精神藥品管理條例》、《放射性藥品管理辦法》、《血液製品管理條例》、《疫苗流通和預防接種管理條例》、《反興奮劑條例》、《易制毒化學品管理條例》、《中藥品種保護條例》等。
根據《中華人民共和國藥品管理法》,國家藥品監管部門制定了29個規章,主要包括《藥品召回管理辦法》、《藥品註冊管理辦法》、《藥物非臨床研究質量管理規範》、《藥物臨床試驗質量管理規範》、《藥品生産監督管理辦法》、《藥品經營許可證管理辦法》、《藥品流通監督管理辦法》等。藥品監管部門還與衛生、工商、海關等部門聯合發佈了《藥品不良反應報告和監測管理辦法》、《藥品廣告審查發佈標準》、《藥品廣告審查辦法》、《藥品進口管理辦法》、《蛋白同化製劑、肽類激素進出口管理辦法(暫行)》等規章。
中國政府重視醫療器械管理法規的制定。2000年,國務院頒布《醫療器械監督管理條例》。根據該條例,國家藥品監管部門制定了10個規章,主要包括《醫療器械註冊管理辦法》、《醫療器械的分類規則》、《醫療器械標準管理辦法》、《醫療器械臨床試驗規定》、《醫療器械生産監督管理辦法》、《醫療器械生産企業質量體系考核辦法》、《醫療器械説明書、標簽和包裝標識管理規定》等。藥品監管部門還與工商部門聯合發佈了《醫療器械廣告審查標準》、《醫療器械廣告審查辦法》。
目前中國已形成了以《中華人民共和國藥典》和局頒標準為核心的國家藥品標準體系。藥品標準和部分醫療器械質量標準屬於國家強制性標準。中國現有國家藥品標準總計1.5萬餘種;醫療器械標準686項,其中,國家標準155項,行業標準531項。
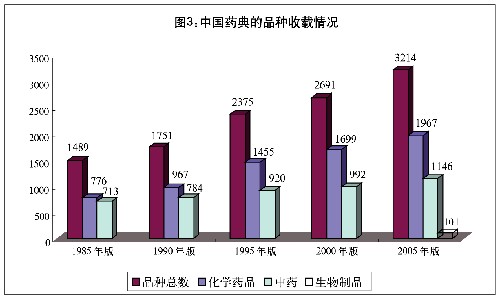
圖表:圖3:中國藥典的品種收載情況 新華社發
早在1953年,中國政府有關部門就編印發行了《中華人民共和國藥典》,截至目前,共頒布了8版,現行版為2005年版。2005年版藥典收載的品種較以往有較大幅度增加,並且擴大了現代分析技術的應用,更加重視藥品安全性指標,對製劑通則、分析檢驗方法和指導原則等進行了增修訂。2005年版藥典一部收載中藥材及飲片、植物油脂和提取物、成方和單味製劑等,共1146種;2005年版藥典二部收載化學藥品、抗生素、生化藥品、放射性藥品以及藥用輔料等,共1967種;2005年版藥典三部收載生物製品,共101種。
中國重視國家藥品標準的提高和規範,鼓勵企業制訂和執行高於國家標準的註冊標準。政府有關部門正在分期分批對現行國家藥品標準進行規範和提高,使國家藥品標準的檢測技術逐步達到國際先進水平。
三、藥品安全監管的政策措施
中國從國情出發,借鑒國際先進經驗,圍繞提高藥品安全性、有效性和質量可控性,制定政策措施,建立了涵蓋藥品研究、生産、流通、使用各環節的重要監管制度。
藥品市場準入制度
為了從源頭保障藥品質量安全,國家對藥品品種、藥品生産經營企業以及相關涉藥人員實行審批和資格認證制度。
——實行藥品註冊。對上市的新藥、仿製藥和進口藥品,實行嚴格的技術審評和行政審批。在中國境內,只有取得藥品批准文號或進口藥品註冊證書(醫藥産品註冊證)的,方可生産或銷售。根據各類藥品申請的研究內容和技術要求特點,國家藥品監管部門陸續制定並頒布實施了54項藥品研究技術指導原則,基本建立了符合中國實際的藥品註冊技術審評體系。
——實行藥品企業市場準入。對所有申請生産、經營藥品的企業進行審核,重點審核人員資質、廠房環境、設備設施、營業場所、倉儲條件、質量管理機構等,符合條件的發放生産或經營許可證。自藥品生産、經營許可證制度實施以來,藥品監管部門通過定期檢查、換證工作,對藥品生産經營企業進行清理。對原料藥生産企業同樣實行許可管理,只有獲得許可的企業,才能生産經營原料藥。
——實行生物製品批簽發管理。國家對規定範圍內的每批生物製品在出廠上市或者進口時進行強制性檢驗、審核,檢驗不合格或者審核不被批准者,不得上市或者進口。從2001年開始,國家分階段對疫苗、血液製品、用於血源篩查的體外診斷試劑等生物製品實施國家批簽發。2006年1月1日起,對所有預防用疫苗類製品實施批簽發。2008年1月1日起,對所有血液製品實施批簽發。生物製品批簽發制度的實施,在控制艾滋病等傳染性疾病傳播,保障公眾健康等方面發揮了重要作用。
——實行藥品包裝材料、標簽和説明書審批管理。包裝、標簽、説明書是公眾獲取藥品信息的重要渠道。在中國,直接接觸藥品的包裝容器和材料必須符合藥用標準,同時,藥品包裝也必須印有或者貼有標簽並附有説明書。藥品監管部門按照《藥品説明書和標簽的管理規定》,對藥品包裝、標簽和説明書進行備案審核。
——實行執業藥師資格認證。對企業藥學專業技術人員實行資格考試、註冊管理和繼續教育的崗位準入控制,以保證藥品質量和藥學服務質量。自執業藥師資格制度實施以來,藥品監管部門逐步組建了考試、註冊管理機構,規範了繼續教育,形成了比較完善的組織工作體系。截至2007年底,全國15萬餘人取得執業藥師資格。
藥品質量管理規範
國家對藥品研究、生産、流通等環節實行質量管理規範認證制度,從全過程加強藥品質量安全控制。
——推行藥物非臨床研究質量管理規範(簡稱藥物GLP)認證。為了提高藥物非臨床研究的質量,確保實驗資料真實、完整、可靠,1999年國家頒布了《藥物非臨床研究質量管理規範》,並從2007年4月起實施藥物GLP認證。目前共有27家藥物非臨床研究機構通過了藥物GLP認證。自2007年1月1日起,未在國內上市銷售的化學原料藥及其製劑、生物製品,未在國內上市銷售的從植物、動物、礦物等物質中提取的有效成分、有效部位及其製劑,從中藥、天然藥物中提取的有效成分及其製劑,以及中藥注射劑的新藥非臨床安全性評價研究,都必須在通過藥物GLP認證的實驗室進行。
——推行藥物臨床試驗質量管理規範(簡稱藥物GCP)資格認定。為了保障藥物臨床試驗中受試者權益和臨床試驗結果的科學性、可靠性,1999年國家頒布了《藥品臨床試驗質量管理規範》,並從2004年3月1日起實施藥物GCP資格認定。截至2007年底,通過藥物GCP資格認定的臨床試驗機構共計178家。藥物GCP資格認定工作推動了中國藥物臨床試驗質量大幅度提高,越來越多的國際多中心臨床試驗在中國開展。
——實行藥品生産質量管理規範(簡稱藥品GMP)認證。為保證藥品生産質量可控,改革開放之初,中國引進藥品GMP的概念,1988年頒布了藥品GMP並於1995年開始受理認證申請,現行藥品GMP是1998年的修訂版。結合國情,國家按藥品劑型類別分步實施藥品GMP。1998年完成對血液製品生産企業的藥品GMP認證;2000年完成對粉針劑、凍乾粉針劑、大容量注射劑和基因工程産品生産企業的藥品GMP認證;2002年完成對小容量注射劑生産企業的藥品GMP認證。2004年實現化學原料藥和全部藥品製劑在符合藥品GMP的條件下組織生産的目標,未通過認證的企業全部強制停産。從2006年1月1日起,分階段實現了體外生物診斷試劑、醫用氣體、中藥飲片在符合藥品GMP條件下組織生産的目標。通過全面實施藥品GMP認證,淘汰了不達標的企業,促進了企業質量管理水平提升和醫藥産業結構調整。
——實行藥品經營質量管理規範(簡稱藥品GSP)認證。為了控制藥品在流通環節可能發生質量事故的因素,消除質量事故隱患,2000年國家頒布了《藥品經營質量管理規範》。藥品GSP認證工作經過了2001年認證試點、2002年正式受理以及2003年各省(自治區、直轄市)藥品監管部門組織轄區內藥品經營企業認證等三個階段。通過實施藥品GSP認證,中國藥品經營企業的整體水平有了較大提高,經營條件得到了很大改善,一批不規範經營的企業被淘汰。
藥品分類管理制度
從1995年起,中國開始探索藥品分類管理工作。1999年,頒布了《處方藥與非處方藥分類管理辦法(試行)》,逐步對處方藥與非處方藥進行分類管理。遴選和審批非處方藥品種,開展處方藥與非處方藥的轉換工作,先後公佈了4610種非處方藥(含中成藥)。規範非處方藥管理,制定非處方藥説明書範本和説明書規範細則,公佈了非處方藥專有標識。藥品監管部門將藥品分類管理與藥品零售企業GSP認證工作緊密結合,出臺了處方藥與非處方藥分櫃擺放、處方藥不得開架自選銷售、零售藥店分類管理等規定。近年來,國家不斷加大處方藥監管力度,逐步加強處方藥廣告管理,停止了處方藥在大眾媒介的廣告發佈。穩步推行處方藥憑處方銷售管理制度,先後出臺注射劑、抗菌藥、激素等11類處方藥必須憑處方銷售的強制性規定。通過開展宣傳和培訓,提高公眾對藥品分類管理必要性的認識和理解。
特殊管理藥品監管制度
中國政府歷來重視麻醉藥品、精神藥品等特殊管理藥品和易制毒化學品、興奮劑等的監管工作,嚴防流入非法渠道。作為《1961年麻醉品單一公約》、《1971年精神藥物公約》、《聯合國禁止非法販運麻醉藥品和精神藥物公約》和《反對在體育運動中使用興奮劑國際公約》的締約國,國家制定了麻醉藥品、精神藥品、易制毒化學品、興奮劑等的管理法規和相應規章,並且制定和完善管理目錄,建立了各部門協作的全面監管體系,積極強化特殊管理藥品的監管。多年來,國家規範麻醉藥品、精神藥品和易制毒化學品的生産、流通秩序;建立監控信息網絡,對特殊管理藥品流向和數量實施動態監控;建立健全藥物濫用監測網絡,對藥物濫用情況及其變化趨勢進行監測,對麻醉藥品和精神藥品安全管理突發事件進行預警。針對近年出現的咖啡因販毒案件、冰毒案件、氯胺酮濫用案件等,國家組織對咖啡因市場進行專項檢查,加強冰毒前體麻黃素的監管,調整麻醉藥品、精神藥品目錄,將有關物質納入目錄管理範圍。
醫療器械監管制度
2000年中國發佈實施《醫療器械監督管理條例》,初步建立了以産品上市前審批、上市後監督和警戒以及對生産企業監管為核心的醫療器械監管體系。其中,警戒主要包括不良事件監測、再評價和預警召回等制度;對生産企業監管的主要手段包括質量監督抽驗、日常監管、專項檢查和生産質量管理體系檢查等。國家對醫療器械實施註冊管理,註冊審查包括産品檢測、臨床試驗、生産質量管理體系現場審查等內容。根據風險程度的不同,將醫療器械産品分為一類、二類、三類,其中,三類醫療器械是指植入人體,用於支持、維持生命,對人體具有潛在危險,對其安全性、有效性必須嚴格控制的醫療器械。境內三類醫療器械和境外醫療器械産品的註冊技術審評工作,由國家級醫療器械技術審評機構完成。境內一類和二類醫療器械的註冊技術審評工作,由省級醫療器械技術審評機構完成。現行的《醫療器械分類目錄》中,按照一類管理的醫療器械有108種,按照二類管理的醫療器械有127種,按照三類管理的醫療器械有71種。
國家基本藥物制度
中國把基本藥物制度作為保證“人人享有初級衛生保健”的重要基礎,積極建立並完善國家基本藥物制度,先後兩次系統地遴選基本藥物,四次調整基本藥物目錄。中國的基本藥物目錄涵蓋了西藥和中藥。2006年7月,國家啟動城市社區和農村基本用藥工作,陸續公佈了“首批城市社區、農村基本用藥目錄”、第一批基本用藥定點生産企業名單、第一批定點生産的基本用藥品種,並對定點生産的藥品品種實行單獨定價,引導藥品生産企業為城市社區、農村醫療機構提供最常用的廉價藥品。基本藥物制度相關工作的開展,對滿足廣大人民群眾基本用藥需求,引導公眾合理用藥發揮了積極作用。
四、中藥和民族藥的監管
中藥和民族藥是中國醫學科學的特色與優勢,是中華民族優秀文化的重要組成部分。目前,國家批准上市的中成藥共有9000多種,約計5.8萬個批准文號。2007年,中藥工業總産值達1772億元人民幣,佔整個醫藥工業總産值的26.53%。中國政府高度重視中藥在醫療預防保健中的作用,制定一系列行政法規和政策,不斷完善中藥監管,推動中藥質量水平的穩步提高。
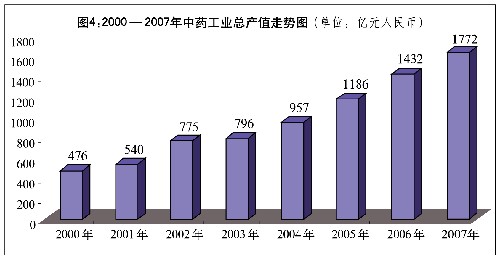
圖表:圖4:2000—2007年中藥工業總産值走勢圖 新華社發
不斷完善國家中藥標準體系。現行的中藥國家標準有7014個。其中,2005年版《中華人民共和國藥典》收載中藥材、中藥飲片、油脂及提取物582個,中成藥564個;部局頒標準收載中藥材、中藥飲片438個,中成藥4690個,民族藥材308個,民族成藥432個。為確保中藥注射劑的安全性和有效性,建立有效的質量控制方法,國家加強了中藥注射劑標準化工作,2000年啟動“已批准生産的中藥注射劑質量標準的提高完善及指紋圖譜工作”,發佈了《中藥注射劑指紋圖譜研究技術要求》。目前,國家正在全面提高123種已上市中藥注射劑的安全性與質量控制方法和指標,督促中藥注射劑生産必須固定藥材産地,嚴格控制原料藥材、中間體和成品質量,實現對生産加工的全程質量控制。
實行中藥品種保護制度。1992年,國家頒布實施《中藥品種保護條例》,鼓勵研製開發臨床有效的中藥品種,對質量穩定、療效確切的中藥品種實行分級保護。中藥品種保護制度推動了中藥整體質量水平的提高和科技進步,提高了中藥生産的集約化水平。截至2007年底,先後公佈2469個國家中藥保護品種。
加強中藥材管理。中藥材直接影響中藥飲片和中成藥的質量。國家採取綜合措施加強中藥材管理,保護中藥種質和遺傳資源,加強優選優育和中藥種源研究,從源頭提升中藥質量。目前,初步建立起中藥數據庫和種質資源庫,並開展了珍稀瀕危中藥資源保護研究,全面禁止犀角、虎骨等珍稀瀕危動物入藥使用,限制天然麝香、天然牛黃等珍稀中藥資源的使用範圍,開展珍稀瀕危中藥資源的替代品研究。中藥飲片、中成藥的主要原料藥材已實現人工栽培,正在逐步發展規範化種植和産業化生産。2002年,國家頒布實施《中藥材生産質量管理規範(試行)》(簡稱中藥材GAP),目前已在全國範圍內試行中藥材GAP認證。藥品監管部門對提出認證申請的企業進行了現場檢查,截至2007年底,有48家企業通過了中藥材GAP認證。
提高中藥飲片生産規範水平。中藥飲片炮製是中藥生産的特色工藝,具有地域差異性。中藥飲片質量標準包括《中華人民共和國藥典》、《全國中藥材炮製規範》和地方中藥材炮製規範。從2004年開始,國家推行中藥飲片GMP認證,促進中藥飲片現代化。截至2007年底,已有343家企業通過了中藥飲片GMP認證。自2008年1月1日起,所有中藥飲片生産企業必須在符合GMP的條件下生産。
五、藥品安全監管的國際交流與合作
中國高度重視並積極參與各類國際藥品安全活動,不斷拓寬對外交流合作的渠道和領域,並認真履行國際義務,為維護世界各國消費者用藥安全發揮積極作用。
中國藥品監管部門積極開展國家間的交流與合作,已同美國、加拿大、法國、英國、歐盟、意大利、澳大利亞、古巴、巴西、韓國、新加坡、泰國等國家和地區的藥品監管當局簽署了合作協議或備忘錄。2007年,中國與美國就藥品、醫療器械安全合作簽署了合作協議,包括建立兩國藥品監管部門高層領導人會晤機制、加強對原料藥(活性藥物成分)的進出口監管等重要內容,為國家間合作解決進出口藥品和醫療器械質量安全問題提供了有效途徑。中國與美國、加拿大、法國、歐盟、意大利、澳大利亞、新加坡、泰國等國家和地區在傳統藥物等領域的合作取得重要成果,20個中藥材品種進入法國植物藥用藥手冊目錄,7個中藥材標準進入法國藥典,4個中藥材標準由法國推薦進入了歐洲藥典。中國與日本合作實施中日友好藥物安全評價監測中心合作項目,建成了基本符合國際GLP規範的“國家新藥安全評價監測中心”。中國與英國、俄羅斯等國家利用經貿合作聯委會機制,在進出口藥品和市場準入等方面進行了交流合作,促進了藥品貿易的正常開展。
中國積極鞏固和發展與世界衛生組織的合作關係。中國先後執行了基本藥物制度建立、打擊假藥、監控抗生素的使用、提高藥物可獲得性、藥品法規比較研究、生物製品安全性、信息建設等世界衛生組織計劃內項目,以及藥品不良反應(ADR)監測、GCP、疫苗GMP檢查員培訓等計劃外項目。積極參加世界衛生組織在藥品領域組織的各類重要活動,在質量標準等方面進行了廣泛交流。中國積極承辦各種國際會議,通過與國際組織的合作與交流,進一步了解國際藥品監管現狀和動向,汲取先進經驗,為提升監管水平和參與國際協調發揮了積極作用。
近年來,中國與其他國家和地區在藥品領域的非官方交流與合作日益活躍。中國藥品生物製品檢定所和國家藥典委員會分別與美國藥典會、歐洲藥典會簽署了合作備忘錄,與英國國家生物製品檢定所簽署了合作協議。中國醫藥國際交流中心先後與20多個國家和地區的民間團體、學術組織等建立合作關係。中國藥學會每年派團參加世界藥學大會,並與美國藥師協會、日本藥學會等建立了日常工作聯絡。中國還積極開展與國際行業協會、學會、駐華商會的交流,推動中外醫藥界的廣泛交流與合作。中國醫藥保健品進出口商會與日本、韓國、俄羅斯等20多個國家和地區的政府機構、行業組織建立了協作關係,促進藥品知識産權保護,倡導藥品進出口企業自律經營。
通過多年持續不懈地努力,中國的藥品安全監管工作取得了顯著進展。但是,作為世界上最大的發展中國家,中國的藥品安全監管還面臨著許多困難和問題。在醫藥産業結構調整和增長方式的轉變、藥品安全監管體制的改革、藥品研製和創新能力的提升、藥品安全風險的防控等方面,還有許多工作要做。今後,中國政府將深入貫徹落實科學發展觀,堅持以人為本,進一步加強藥品安全監管工作,努力促進廣大公眾健康水平的不斷提高。中國將繼續加強藥品領域的國際交流與合作,同世界各國一道,為各國消費者提供安全、有效、質量可控的藥品,為人類健康事業作出貢獻。

